犬瘟热(Canine Disease,CD)是由犬瘟热病毒(Canine Distemper Virus,CDV)引起的犬科、鼬科和部分浣熊科动物的急性、热性、高度接触性传染病。在犬所患的各种疾病中无论是传染强度,病情的严重程度,还是死亡率都可列榜首。是对养犬业,毛皮动物养殖业和野生动物保护危害最大的疾病之一。
伴随生态环境的改变、动物和病毒的进化,CDV 的自然感染宿主已由传统的犬科、鼬科和浣熊科扩展到了食肉目所有 8 个科、偶蹄目猪科、灵长目的猕猴属和鳍足目海豹科等多种动物,CDV 自然感染的动物范围还有不断扩大的趋势,其危害也越来越大。大熊猫等珍稀野生动物及猕猴等灵长类动物的 CDV 感染,使 CDV的致病地位日益突出。目前,犬瘟热记载于所有从事毛皮动物饲养业的国家。1905 年 Carre 首次发现 CDV,所以本病也曾称为Carre 氏病。银黑狐 CD首先由 Green 于 1925 年在美国养狐场发现 [1] 。1928 年 Rudolf同时发现了银黑狐、水貂和貉 CD,1953 年 C.E. 苏列纳确诊了紫貂 CD,1957 年
B.A.潘柯夫报道了北极狐 CD,我国从 1972 年起陆续在水貂、狐、貉等毛皮动物中发生犬瘟热 [2] 。国内的熊猫、东北虎、狮子、猞猁、熊、狼、等动物均有感染 CDV的报道
CDV 可在来源于犬、貂、猴、鸡和人的多种原代细胞与传代细胞上生长,但初次培养较困难,一旦适应某一细胞后,即易在其他细胞上生长。其中,以犬肺巨噬细胞最为敏感,
临床上,犬、狐和水貂等各毒株之间虽可相互感染,但仍以对本动物致病性最强。实验感染可使雪貂、乳鼠、犬等发病,其中以雪貂最为敏感,为公认的 CDV 实验动物。用貉做试验动物研究犬瘟热,具有比貂敏感、临床与病理解剖变化典型、规律等特点。
在中兽医的理论中犬瘟热属于瘟疫的范畴。
【病原特征】
犬瘟热病毒(Canine Distemper Virus,CDV)与麻疹病毒(Measles virus,MV)、牛瘟病毒(Rinderpest virus)、小反刍兽疫病毒(Peste des petits ruminants pestivirus,PPRV)、海豹瘟热病毒(Phocine distemper virus,PDV)、海豚瘟热病毒(Dolphin distemper virus,DDV)、鼠海豚瘟热病毒(Porpoise morbilli virus,PMV)同属于副黏病毒科麻疹病毒属成员,与麻疹病毒亲缘关系最近。
CDV 为不分节片的负链 RNA 病毒,由 15 616 个核苷酸组成,分子量为 6×10 6 kD。病毒粒子呈现多形性,多数为球形,病毒粒子直径 120~330nm,粒子中心含有直径 15~19 nm的螺旋形的核衣壳,主要由 N蛋白组成,P 蛋白和 L蛋白也是核衣壳成分。外面被覆一近似双层轮廓的膜,膜上排列有长约 1.3nm 的杆状纤突,纤突只含有血凝素,而无神经氨酸。从 CDV的 3′端到5′依次为 3′端前导序列、核衣壳蛋白基因(Nucleo-capsid protein gene,N)、磷 蛋 白 基 因(Phosphoproteingene,P)、基质膜蛋白基因(Matrixprotein gene,M)、融合蛋白基因(Fusion protein gene,F)、附着或血凝蛋白基因(Attachment protein gene,H)、大蛋白基因 (The largevirus specified RNA directed RNA polymerase proteingene,L)和 5′引导序列 [5] 。
N蛋白是核衣壳主要组成成分。N、P、L 蛋白与病毒 RNA 一起构成核糖核蛋白复合体(RNP),RNP 可指导 6 个转录单位顺序合成加帽和聚腺苷酸化的 mRNA及反基因组 RNA的复制。N蛋白基因由 1 683 个核苷酸组成,位于病毒核苷酸的 56~1 738 位上,有 1 个开放阅读框架,起始于 53~55 位的 AUG,编码 523 个氨基酸。在接种病毒 9 h 后,可检测到 N蛋白 [6] 。
据 Hamburger 等 [7] 报道,CDV 的毒力与 N 蛋白密切相关,CDV 的毒力在中枢神经系统的持续性感染中具有重要作用。CDV强毒在原代脑细胞培养物中不产生细胞病变(CPE),但能保持其毒力,接种动物时能够产生慢性、进行性脱髓鞘性紊乱。抗 CDV N 蛋白的单抗 L1 能与在 Vero细胞上传代致弱的 CDV 无毒株的 N蛋白结合,但不能与强毒结合,然而,当强毒株在 Vero细胞上传代数次后,L1 便能与其 N 蛋白结合,强毒株在 Vero细胞上传代后,毒力丢失 [8] 。CDVN蛋白氨基酸序列可分为 3 个区,即 N 端可变区(17~159)、C 端可变区(408~519)和中间的高度保守区,中间保守区含有 N蛋白 - RNA 相互作用、病毒 RNA 的核衣壳化,以及核衣壳的包装等所必需的信息。这个区域的任何变化都有可能导致包装不完全,而使病毒死亡。CDV强毒株 N末端可变区氨基酸的改变,对 N蛋白的大小和管状外形没有影响,对 N末端的二级结构的影响不大。CDV强弱毒株结构的变化主要在 C 末端,C 末端是相对亲水的,它分布于蛋白质的表面,其适合与碱性的 M蛋白作用,使之包裹在核衣壳的外面,C 末端结构的变化能导致 M蛋白对核衣壳吸附作用的改变。强弱毒株 C末端的不同能够导致病毒的装配、囊膜的形成和病毒在细胞表面释放的不同 [6,9] 。
野毒株与疫苗株 Onderstepoort 的 N蛋白及其基因的同源性分别为 95.2%和 93.2%,氨基酸序列差别最大的区域是 N端和C端 [6] 。MVN蛋白是 CTL活性的主要靶蛋白之一,其 9 个氨基酸寡肽(281~289 位氨基酸,Tyr- Pro- Ala- Leu- Gly- Leu- His- Glu- Phe,CDV 的 N 蛋白中也有此表位)能诱发 MHC I 类抗原限制性 CTL 反应,重组该表位的牛瘟病毒可保护小鼠免受 CDV 的致死性攻击,但是不能阻止病毒的复制 [10] 。
F 基因长为 2 205 个核苷酸,位于基因组的 4845~7 059 位上,含有 1 个开放性阅读框架,在阅读框架上有 3 个可利用的起始密码子分别位于 86~88、266~268、461~463 位核苷酸,研究表明 F 蛋白在体内翻译时实际起始位点应为 461~463。然而 Cherpillod P等 在研究 A75/17 株的表达中发现,与 Onderstepoort株 AUG 相对应的位置(461~463),在 Onderstepoort 株曾被认为是翻译起始密码子,而 CDVA75/17 株此位置的密码子是 AUA,编码 Ile 即不存在 461~463 这个起始密码子,A75/17 是利用第 2 个起始密码子开始翻译的。
CDV 野毒株与疫苗株 F 蛋白及基因的同源性分别为 95.7%和 90.1%,F 蛋白的 13 个半胱氨酸残基和 4个潜在的 N- 联糖基化位点完全保守,说明 CDV F 蛋白的同源性较 H 蛋白间的同源性高 [12] 。
H 蛋白是Ⅱ类糖蛋白,N 端的 35~55 位氨基酸形成了 H 蛋白仅有的疏水锚定区,一方面为穿膜的信号序列,另一方面为 H 蛋白的锚定区 [8] 。野毒株及疫苗株H 蛋白的潜在糖基化位点不同,野毒株为 8~9 个 [13] ,而Convac 和 Onderstepoort 株 分 别 为 7 个 和 4 个 ,即309~311 位的糖基化位点是野毒株特有而疫苗株没有的,当用衣霉素阻断糖基化时,Onderstepoort 株和日本的 3 个野毒株 H 蛋白的分子量均为 68 kD,H 糖蛋白的糖类成分前者可能是 10 kD,其膜外的 3 个糖基化位点可能都用上了,后者可能是 16 kD,可能利用 6~8 个糖基化位点,糖基化的不同可能影响病毒的抗原性 [13] 。
H 蛋白是诱导机体产生中和抗体的主要蛋白之一,是抗 CDV 免疫的很重要的抗原,抗 CDV H 蛋白单克隆抗体(McAb)具有中和病毒活性,对实验鼠的保护力强于抗 F 蛋白的 McAb [14] 。H 蛋白基因序列的系统发生分析表明 CDV 存在不同基因型,新分离病毒 H 蛋白基因的遗传变异可能是近年来爆发 CD的重要原因 [15] 。
当 CDV接触到细胞后,由 H 和 F 两种蛋白共同作用使病毒吸附在细胞的受体上,F 蛋白发挥融合作用使其自身的囊膜与细胞膜发生融合,CDV 核衣壳进入细胞内,核衣壳在细胞内酶的作用下,分解成链状 RNA,此 RNA 在自身 P 蛋白和 L 蛋白的催化下,转录各种mRNA 和反基因组 RNA,各种 mRNA 作为翻译病毒复制中所需的某些酶类和病毒结构蛋白的模板。正链RNA是复制基因组负链 RNA的模板,当病毒核苷酸和结构蛋白合成到一定程度后,使细胞膜发生融合,形成合胞体,开始新的循环,造成 CPE 。
【病毒稳定性与灭活】
CDV 对环境的抵抗力非常弱,易被光和热灭活。CDV在 - 10℃可生存几个月,在 - 70℃或冻干条件下可长期存活,在 0℃以上感染力迅速丧失,干燥的病毒在室温中较稳定,在 32℃以上则易灭活,60℃以上的水浴灭活效果与紫外线一样。CDV 在 pH3.0 时不稳定,在pH4.5 以上时稳定,pH7.0 有利于病毒保存。CDV 对乙醚、氯仿等有机溶剂敏感。0.1%甲醛、1%煤酚皂液、70%乙醇、3%的 NaOH 以及 0.05%NH 4 Cl 可在几小时内灭活病毒,故常用于对其消毒。
【流行病学】
CD分布广泛,目前呈世界性流行,已成为危害毛皮动物的三大主要传染病(犬瘟热、病毒性肠炎、阿留申)之一。伴随生态环境的改变、动物和病毒的进化,CDV 的自然感染宿主已由传统的犬科、鼬科和浣熊科扩展到了食肉目所有 8 个科、偶蹄目猪科、灵长目的猕猴属和鳍足目海豹科等多种动物,CDV 自然感染的动物范围还有不断扩大的趋势,其危害也越来越大。大熊猫等珍稀野生动物及猕猴等灵长类动物的 CDV 感染,使 CDV的致病地位日益突出。目前,犬瘟热记载于所有从事毛皮动物饲养业的国家。
近年由于养犬业及皮毛动物养殖业迅速发展,大范围易感动物的运输,动物整体免疫水平不均衡,导致 CDV 的发病规律不再具有季节性、周期性和地域性。但相对春季、秋季发病率较高。不同年龄,性别,品种的犬均可感染,而且没有某个犬种发病率一定高于其它品种的特征。以断奶至1岁以内幼犬易感,尤其以2~6月龄最易感,发病率高,已注射1~3次犬五连疫苗的幼犬也常有发病,成犬发病也呈上升趋势。哺乳期仔犬鲜有发病。一旦发病,是否免疫与治愈率之间没有明显线性关系。单独饲养的犬发病率低,群养犬易发,而且常常迅速蔓延,较难控制;由外地引入的犬,由于短期内环境适应能力差,比本地犬发病率高;引进纯种犬较本地土种犬和杂交犬易感性明显增高,而且一旦发病症状严重,治愈率较低。此外,气候突变、饲养条件恶劣、营养缺乏等因素都是该病暴发的诱因 。
病犬和带毒犬是本病的最主要传染源,可通过泪液,鼻液,唾液,尿液及呼出气体排毒。病犬临床恢复后,可长时间地向外排毒,成为不被人们注意的传染源。本病主要通过呼吸道和消化道感染,由飞沫传播,通过鼻腔粘膜以及阴道,直肠粘膜感染。病犬及死亡犬的各种内脏器官组织及体液对环境的污染更强。健康犬与病犬直接接触,可通过污染的空气溶胶微滴或食物,饮水而经呼吸道或消化道感染,也可经眼角膜和胎盘传染,其传播性特别强。CD康复犬可获终生免疫。
【潜伏期】
犬瘟热的潜伏期随机体的免疫状况和病原来源而有较大差异。一般来源于同种动物的病原潜伏期为3~6天;来源于异种动物的病原,需要经过适应新的机体细胞后,才能繁殖,因而潜伏期可长达70~90天。
【症 状】
犬瘟热病型复杂多样,主要特点为双相型发热,眼、鼻、消化道等黏膜炎症。急性鼻卡他以及随后的支气管炎、 卡他性肺炎、 严重的胃肠炎,以及非化脓性脑膜 - 脊髓炎,内脏组织器官病变和神经症状为特征。采用调查统计的方法分析病犬的发病类型和相关的病理学变化,根据病犬临床症状可划分为:呼吸道型、消化道型、神经型。
1. 体温
多数犬在感染后的4天左右出现体温升高,达39.5℃~41.5℃,或持续1~2天,可伴有厌食,而其它方面没有太明显的症状,此时为初期阶段。在此阶段,如机体不能产生保护性抗体,经过2~3天的无热期后,体温将再度升高,出现典型的双相热,病情加重,精神沉郁,进而出现更多复杂的临床症状,从而进入犬瘟热的中期阶段。同时,随着犬瘟热疫苗的大范围接种及变异毒株等诸多因素的不断出现,许多 CDV 感染动物不再出现典型特征。从开始发病直至痊愈或死亡,也不会出现体温升高,或只是短暂呈现体温升高。
2. 眼睛
之所以把眼睛做为单列项来讨论,是几乎所有犬瘟热病犬,在眼睛方面都会有临床症状表现。通常眼结膜潮红,羞明流泪,逐渐变为脓性分泌物,重者可将上下眼睑粘在一起。有时并发角膜炎,角膜浑浊、溃疡。甚至发生肝炎性蓝眼病,角膜在1~2天内被蓝色膜覆盖,进而穿孔。眼睛的症状通常会贯穿整个疾病过程中,不过角膜溃疡,变色,及穿孔只会出现在中后期。
3. 上呼吸道感染
虽然犬瘟热症状复杂多样,但是多数病犬首先表现上呼吸道感染症状。鼻镜干燥,流浆液性鼻涕,逐渐变为粘液性,颜色不一的脓性鼻涕,重症的可堵塞鼻道,并多见咳嗽及呼吸困难。肺部听诊,有湿性啰音或捻发音。此时属于中期阶段。
4. 消化道症状
有些病犬在感染的初期只表现单纯的消化道症状,轻中度腹泻或呕吐。随着病情的加重,食欲减少或废绝,呕吐白色粘液或棕色粘液样物质。稀便有时带血,呈粘液糊状或焦油状或水样,散发腥臭、恶臭、刺鼻气味。病犬迅速脱水、消瘦,严重者可引起肠套叠。消化道症状如不是非常严重,通常属于中期阶段。
5. 神经症状
犬瘟热的神经症状是影响预后和感染恢复的最重要因素。病犬在感染犬瘟初期即出现神经症状的病例较为少见,但是现在有上升趋势。大多数情况下,神经症状都是出现在呼吸道和消化道症状之后。病毒对神经细胞的损害不是突然发生的,是一个从量变到质变的过程,当这种损害程度达到一个临界点,病犬才突然表现临床症状。神经症状的形式和发生部位多样,全身任何部位的抽动,抽搐都表示病犬已经出现神经症状。有时,神经症状在开始的阶段表现并不明显,可能只是肢体无力,走路不稳,或者出现类似于人在寒冷时候,打寒颤样的快速抖动。有的个体会表现异常敏感,稍加碰触既表现强烈反应。随着神经症状的加重,病犬可发生明显的共济失调,癫痫样抽搐、空嚼、吐白沫、大小便失禁、强直、反弓;身体多个部位以一定的节奏和频率抽动,跳动。神经症状稍微严重,病犬会表现呻吟,甚至哀嚎;意识模糊、不认识主人。更严重者会出现瘫痪,心肺衰竭、甚至多器官衰竭。
由于犬瘟热病毒侵害中枢神经系统的部位不同, 临床症状有所差异。 大脑受损病犬轻则口唇、 眼睑局部抽动, 重则流涎空嚼、或转圈冲撞、或口吐白沫、牙关紧闭、倒地抽搐、呈癫痫样发作;咀嚼肌群反复出现阵发性抽搐是犬瘟热的常见症状。 中脑、 小脑、 前庭和延髓受损表现步态及站立姿势异常; 脊髓受损表现共济失调和反射异常; 脑膜受损表现感觉过敏和颈部强直。
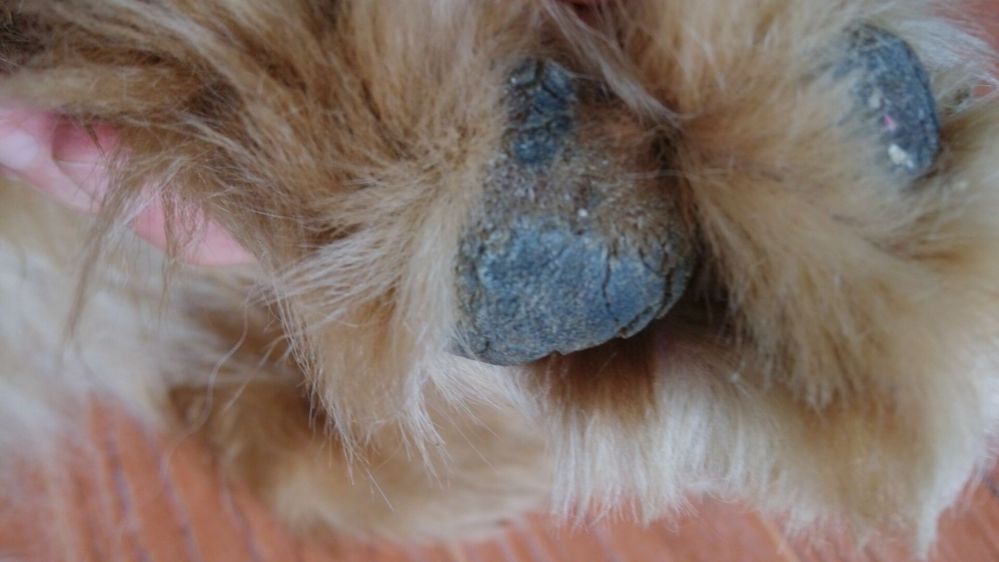
此外,有些病犬下腹部皮肤出现红色或化脓性丘疹,少数严重者会出现遍布全身的脓皮症。绝大多数病犬会出现足垫,鼻镜角质化。
【病理变化】
CDV为泛嗜性病毒,可感染多种细胞和组织,对淋巴细胞和上皮细胞的亲嗜性最强,病变分布广泛。 CDV 经由鼻、咽和上呼吸道侵入机体后首先在其附近的淋巴结和扁桃体中增殖, 24h 内在组织巨噬细胞中增殖并扩散至整个细胞, 从局部淋巴管到达扁桃体和支气管淋巴结。 感染后 2~4d ,病毒在扁桃体和咽后淋巴结、支气管淋巴结中繁殖。 4~6d 后CDV 在脾脏淋巴滤泡、胃及小肠的固有层、肠系膜淋巴结和肝脏星形细胞内增殖, 动物表现为最初的体温升高和白细胞减少(主要是淋巴细胞减少)。 感染后第一周出现病毒血症, 借助于血液循环, CDV散布到全身的淋巴器官、骨髓和上皮结构的固有膜,从身体的所有分泌物中开始向外排毒。 50% 的犬于感染后迅速产生抗体, 8~9d 时即可测出。 在感染后8~9d 病毒进一步扩散到上皮组织和中枢神经系统( CNS )组织,身体的所有分泌物中开始向外排毒,甚至处于亚临床感染阶段的犬也开始排毒。 免疫水平良好的犬感染后 14d 具有了足够的 CDV 抗体,动物不表现犬瘟热的临床症状。 免疫水平差的犬在感染后 9~14d 病毒已扩散到许多组织,包括皮肤、内分泌腺、胃肠道上皮、呼吸道上皮、泌尿生殖道上皮等,呈现出病毒侵害多系统的临床症状。 犬瘟热的临床症状通常很严重, CDV 开始在上述组织内生存直到死亡的过程中, 继发的细菌感染将加重临床疾病的严重程度。病犬多表现为结膜炎,化脓性鼻炎、支气管炎、化脓性肺炎、肺组织出血。消化道出现卡他性、出血性胃肠炎。有的病犬脾脏和膀胱粘膜出血。脑膜充血、出血,脑室扩张和因脑水肿所致的脑脊髓液增加。CDV 在脑组织中主要表现为对血管壁细胞的激活过程继而引起神经胶质细胞反应, 出现脱髓鞘性脑炎,在感染后 3~4 周时出现神经症状而死亡。
病理组织学检查淋巴系统发生退行性变化,弥漫性间质性肺炎,泌尿生殖道的变移上皮肿胀;眼睛的睫状体细胞浸润,色素上皮细胞增生。死于神经症状的病犬,呈现非化脓性脑炎及脑白质中的空泡形成,神经细胞和胶质细胞的变性或早期脱髓鞘现象。在粘膜上皮细胞、网状细胞、白细胞、神经胶质细胞和神经元等的胞浆内发现嗜酸性包涵体。
【病毒分离】
研究证实,来源于不同地区、不同动物和不同临床病型的 CDV毒株属同一个血清型。West J 等 [16] 报道,从犬、狐及水貂等动物分离的犬瘟热病毒是一个血清型。临床上,犬、狐和水貂等各毒株之间虽可相互感染,但仍以对本动物致病性最强。CDV和 MV有交叉抗原,但却具有完全不同的宿主特异性。
CDV是具有脂囊膜的病毒,结构较脆,易被光和热灭活,对环境的抵抗力非常弱,所以病毒的分离成功率较低。病料采集的部位、时间、样品处理、病程类型、发病动物的抗病毒抗体水平等因素对病毒分离成功与否有一定的影响,但最主要的是分离病毒的载体是否敏感与有效。分离病毒常用的载体有原代培养细胞及传代细胞系两大类,原代培养细胞包括犬或貂的肺和腹腔巨噬细胞、肾细胞、胚胎细胞、外周血淋巴细胞及 T淋巴细胞,犊牛的肾细胞和 T淋巴细胞,牛胚胎肺细胞和鸡胚成纤维细胞(CEF);传代细胞系包括 Vero、CR-FK、FE、MDCK、BHK21 及 Hela 细胞。在用传代细胞单层培养病毒时,细胞形成单层时间不宜过长,否则影响病毒的敏感性。在分离病毒时,急性病例取血淋巴细胞,亚急性病例取内脏,慢性病例取脑组织。若病兽死后不久或被捕杀时,可取上述样品与细胞载体共培养,或用对 CDV 特别敏感的雪貂作为中介动物载体,均可提高病毒的分离率 [17] 。
钱国成等 [18] 从法国引进的水貂犬瘟热弱毒疫苗中分离获得了犬瘟热弱毒 CDV3 毒株。将 CDV3 弱毒株接种于 9~10 日龄 CEF 中 2~3 d,细胞形成单层生长,接入维持液逐日观察,一般 3~4 d 出现露珠样的融合细胞,也有的细胞呈现破碎感,4~5 d CPE 达到高峰形成拉网状。高云等 [19] 从自然感染病例采毒,复归传代,并以鸡胚、犬肾单层细胞传代分离病毒,获得了 3 株 CDV,3 株病毒产生相同的 CPE,CPE 具有副黏病毒“属”的特性,以法国犬瘟热弱毒苗及分离毒制备了阳性血清,作血清学病毒鉴定,病毒血凝和血抑效价 1∶320,血清抗体中和效价为 1∶160。本病毒属 RNA病毒,不耐乙醚。电镜观察,病毒有囊膜和纤突,核衣壳呈螺旋对称型,病毒颗粒大小为 132~175 nm,位于细胞质内,其结构特点与美国犬瘟热弱毒 Distemink.TC株类似,鉴定分离获得的病毒为 CDV。华国荫等 [20] 通过中和试验、免疫荧光抗体试验鉴定,以及电镜观察等一系列试验证明,貂源 CDV通过貉继代培育后,毒力稳定,与日中野Ⅱ株犬瘟热强毒抗原性相同。用貉做试验动物研究犬瘟热,具有比貂敏感、临床与病理解剖变化典型、规律等特点。
CDV 可在来源于犬、貂、猴、鸡和人的多种原代细胞与传代细胞上生长,但初次培养较困难,一旦适应某一细胞后,即易在其他细胞上生长。其中,以犬肺巨噬细胞最为敏感,可形成葡萄串样的典型 CPE,CEF 应用的最多,既可形成星芒状和露珠样的 CPE,也可在覆盖的琼脂下形成微小的蚀斑。实验感染可使雪貂、乳鼠、犬等发病,其中以雪貂最为敏感,为公认的 CDV 实验动物。
目前,人们正在应用分子生物学技术对 CDV 进行研究。何洪彬等 [21] 首次进行了大熊猫 CDV 血凝蛋白基因序列分析,发现大熊猫 CDV 与疫苗弱毒 Onder-stepoort 株 H 蛋白的同源性较低。同时,GP 病毒株 H 蛋白疏水性和糖基化位点与 Onderstepoort 株比较发生了变化。王君玮 [22] 等通过对分离自山东等地的貂、狐和貉源 5 株 CDV 野毒和疫苗株部分 H 基因氨基酸序列分析,发现两者之间存在较低的同源性(89.75%~91.8%),推测近期某些地区免疫失败现象的发生可能与使用的疫苗株和野毒株的遗传关系较远有关。朱军莉等[23] 对CDV Guangzhou 株的 H 基因进行了克隆和序列分析,发现国内毒株普遍与国外标准疫苗株的同源性存在很大差异。王风雪 [24] 成功克隆了犬瘟热病毒疫苗株 CDV3株的 H 蛋白基因序列,序列分析结果表明 CDV3 株 H基因与疫苗毒株 Convac 和 Onderstepoort 的同源性分别为 97.1%和 97.2%;与国内分离的野毒株同源性为91.5%~92.7%,疫苗株与野毒株基因水平上的差异可能是疫苗免疫失败的重要原因。目前,我国水貂、狐狸、貉等毛皮动物犬瘟热野毒株分子流行病学研究刚刚起步,这些不同是否对 CDV 的致病性、抗原性等产生影响,还有待进一步研究。
【诊断】
犬瘟热病型复杂多样,又常与多杀性巴氏杆菌,支气管败血波士杆菌,沙门氏菌以及犬传染性肝炎病毒,犬细小病毒等病原混合感染或继发感染,所以确诊较困难。根据流行病学特征,临床症状,病理变化可做出初步诊断,确诊需进行实验室检查。
随着犬瘟热疫苗的大范围接种及变异毒株等诸多因素的不断出现,许多 CDV 感染动物不再出现典型特征,一些弱毒感染耐过的动物在不断散播着CDV ,对健康易感动物造成威胁,即使是野毒株感染也只有在感染动物的临床期才能观察到。因此,建立早期快速而准确的检测方法才能控制犬瘟热的流行。整体而言,随着近几年分子生物学及免疫学检测技术的进步,使得 CDV 的诊断变得越来越准确、简便、易行。因每种技术均有其优缺点及诸多限制因素,因此在对疑似犬瘟热感染的动物进行诊断时,最好多种检测方法相结合,以最大限度提高检测的敏感性和特异性。目前 PCR 技术、基因芯片技术、液相芯片技术、 RT - LAMP等已进入临床试验研究阶段,相信随着这些技术的不断成熟和完善,不久
的将来会在临床上广泛应用。
1. 病毒分离培养与镜检观察
CDV的成功分离是进行病原学诊断的基础,也是确诊该病最可靠的方法,但分离率往往较低,这是由于用于 CDV 分离的 细胞 一般不表 达 CDV 受体 。国内外试验结果表明,稳定表达 CDV 信号淋巴激活分子( SLAM )受体的细胞株,能有效分离CDV ,并且不受传代次数限制,产生比传代细胞更明显的细胞病变( CPE )。因此,为了提高CDV的分离率,需对分离 CDV 的常规细胞进行改造。创建稳定表达 CDV - SLAM 受体细胞株的一般方法为:采用分子克隆技术扩增 SLAM 基因,构建 SLAM真核重组表达质粒,并将其转染于拟改造细胞,经G418压 力 筛 选、单 细 胞 克 隆 化、免 疫 荧 光 试 验、RT - PCR 、 Western blotting 等 筛 选 出 稳 定 表 达SLAM 的阳性细胞。将CDV 接种于阳性细胞和亲本细观察CPE情况,判定阳性细胞的敏感度。依据上 述 方 法, NaKano 等 成 功 建 立 稳 定 表 达SLAM 的犬肾细胞和猫肾细胞,为犬瘟热病毒学和血清学分析奠定基础。赵建军等建立的 Vero-rSLAM 细胞系接种 CDV 样品36~48h 即可产生典型 CDV致细胞融合病变,分离的 CDV 保持较强毒力。朱颖等建立了能稳定表达CDV 细胞受体SLAM 的BHK - 21 / SLAM 细胞系,感染 CDV 12h即出现 CPE ,且明显提高了病毒的增殖力,该试验为CDV 的分离、生物学特性研究及疫苗生产等提供了敏感的细胞系。依据 CDV 粒子形态特点对分离培养的病毒采用电镜观察可直观地对病毒类型做出初步诊断。
2 免疫学检测技术
2.1 酶联免疫吸附试验(ELISA )该法是在细菌性、病毒性疾病检测中应用最广
泛的技术,在 CDV 的检测中常用夹心 ELISA法检测CDV 抗原,间接 ELISA 法检测 CDV 抗体。夹心 ELISA 法是以已知抗体(抗 CDV )包被载体,然后将含有 CDV 抗原的待检标本加入,共同孵育后,抗原结合于包被抗体上,再加入酶标抗体(酶标抗CDV抗体),酶标抗体连接到抗原上,最后加入底物溶液,根据颜色反应来判定 CDV 抗原含量。间接ELISA法是以特异性CDV 抗原与固相载体联结,形成固相 CDV 抗原,加入受检样品,样品中的特异CDV 抗体与固相 CDV 抗原结合,形成固相抗原抗体复合物,加入酶标抗 CDV 抗体,固相免疫复合物中的抗体与酶标抗 CDV 抗体结合,从而间接地标记上酶,再加入底物显色,固相载体上的酶量与样本中受检抗体的量呈正相关。 Chan等应用原核表达系统制备CDV H 蛋白,将其作为 ELISA 检测抗原,用于犬血清 CDV 抗体的检测,具有良好的稳定性和特异性。 Litster等对美国某一医疗点用于检测CDV 抗体滴度的ELISA试剂盒的准确性进行检测,结果显示该试剂盒的敏感性为75.7% ,特异性为91.8% ,被证明是测定犬血清中 CDV 抗体滴度的简便有效工具。孙婧等应用杂交瘤细胞融合技术筛选出能生产捕获抗体的 MAb G12杂交瘤细胞株和能生产酶标检测抗体的 MAb A2杂交瘤细胞株,建立检测 CDV 的夹心 ELISA 检测方法并 对 条 件 进 行 优 化,结 果 显 示 应 用 该 方 法 与RT - PC方法同时检测57份样本,符合率为100% ,且与犬的其他病毒性疾病无交叉反应,该方法适用于大批量临床样品检测。
2.2 免疫组化技术
免疫组化技术可对 CDV 在各组织中分布情况进行检测。该方法虽然不能作为犬瘟热的早期和活体诊断,但在病理学研究中意义重大,也可为检测样本的筛选提供依据。其一般步骤为:将固定于中性甲醛溶液中的病料(肾脏、肺脏、脑、淋巴结等)修剪、石蜡包埋制块、切片,经免疫组化染色后在光学显微镜下观察。在染色过程中,为提高观察效果,需进行抗原修复方法、最佳抗体稀释度和反应时间、显色底物及作用时间等相关条件的摸索,最终选择最优的试验条件。刘雯等采用间接免疫组化法对6只人工感染的比格犬肠组织 CDV 抗原进行定位检测,结果显示 CDV 抗原主要在小肠绒毛和李氏隐窝的上皮细胞胞浆内,说明 CDV 对肠组织的损害主要在小肠黏膜上皮组织。张文奎等对确诊为犬瘟热的病貉肺脏、脑、肾脏、胃、脾脏、淋巴结、扁桃体、鼻、足垫、支 气 管 进 行 免 疫 组 化 检 测,确 定 出CDV分布最广泛的器官是扁桃体。 Rentería- Solís等对德国柏林市区97只自由放养的浣熊进行免疫组化检测,结果证实有74只感染 CDV 。该方法制作的标本可长期保存,只需光学显微镜即可观察,与免疫荧光技术相比不需要荧光显微镜这一相对昂贵的仪器,适用于基层兽医单位。
2.3 免疫胶体金技术(犬瘟热快速检测试剂盒检测)
免疫胶体金技术是利用抗原抗体特异性结合的免疫反应原理,将特异性的抗原或抗体以条带状固定在膜上,胶体金标记试剂(抗体或单克隆抗体)吸附在结合垫上,当待检样本加到试纸条一端的样本垫上后,通过毛细作用向前移动,溶解结合垫上的胶体金标记试剂后相互反应,在检测线处形成抗体—待测抗原—金标抗体复合物,再移动至固定的抗原或抗体的区域时,待检物与金标试剂的结合物又与之发生特异性结合而被截留,聚集在检测带上,在对照线处形成抗金标抗体—金标抗体复合物,通过肉眼即可观察显色结果。该技术的关键在于抗体的制备,该法现已发展成为诊断试纸条,使用十分方便。近年来在兽医临床上 CDV 胶体金检测试纸条广泛应用,是基层兽医站和宠物医院确诊犬瘟热最常用的辅助手段。红色推移的速度快、线条明显,是强阳性的表现。虽然其具有简便、快速的特点,但敏感性和特异性相对较低,其检出率还有进一步优化的空间。
3 分子生物学检测技术
3.1 核酸杂交方法
核酸杂交技术是一种根据碱基互补配对原理用已知核酸来检测未知核酸,以此来确定是否感染某种疾病等的分子水平检测技术。用于 CDV 诊断目的的杂交双方是已知序列的 CDV 探针和待测样品中的CDV核酸,杂交后通过特定方法检测,若有杂交信号,则说明样品中存在 CDV 核酸,从而证明CDV感染的存在。该方法的关键是要制备敏感、稳
定、特异的核酸探针。核酸探针过去常用放射性同位素进行标记,放射性同位素标记的优点是敏感度高,对被检样品处理要求不高,假阳性率低,其缺点是半衰期短,费用昂贵,需防护设备,放射自显影时间较长。近年来发展了非放射性标记,如金属汞、半抗原、生物素、酶等,具有保存时间长、检测方便等优点。国外对CDV 核酸杂交技术方法的研究在20世纪80年代至20世纪90年代较多,近年来未见专门报道。张永霞等采用斑点杂交法对 CDVN基因进行地高辛( DIG )标记制备cDNA 探针,用此探针与样品(疑似犬瘟热患病犬鼻液、病死犬脾脏、肝脏、心 脏、肺脏、肾 脏、血液)中 RNA 杂 交检测CDV基因,试验结果表明该法比胶体金诊断试纸检出率高,脾脏是最适宜的检测样本,斑点杂交技术在CDV早期诊断和流行病学调查中有很高应用价值。
3.2 巢式 RT - PCR (nested RT - PCR )
巢式 RT - PCR是一种变异的 RT - PCR ,使用两对 RT- PCR引物。第1对 RT - PCR 引物扩增片段和普通 RT - PCR 相似。第2对引物称为巢式引物(因为其在第1次 RT - PCR 扩增片段的内部)结合在第1次 RT - PCR产物内部,使得第2次 RT - PCR扩增片段短于第1次扩增。巢式 RT - PCR 的好处在于,如果第1次扩增产生了错误片段,则第2次能在错误片段上进行引物配对并扩增的概率极低。因此,巢式 RT - PCR的扩增非常特异。杨井泉等建立了CDV 巢式 RT - PCR 检测方法,并用此法对石河子地区疑似感染 CDV 的病料进行检测,结果表明该 研 究建 立 的巢 式 RT - PCR 不仅能有效检测CDV感染,而且能够检测多种组织样品,补充了形态学、理化和生物学鉴定的不足,减少 RT -PCR 的误检率,适用于 CDV 的早期快速诊断和流行病学调查。 Fischer等采用巢式实时荧光 定量 RT-PCR ( RT - nqPCR )方法分别对疑似患犬瘟热病犬的血液、尿液、直肠黏膜拭子和结膜拭子进行检测,结果显 示 血 液 的 检 出 率 最 高。该 方 法 需 经 过 两 轮PCR反应,与普通 RT - PCR反应相比大大提高了反应的特异性,比免疫层析技术(IC )的敏感性更高,同时又采用限制性片段长度多态性( RFLP )分析技术对扩增的 NC 基因核苷酸序列进行分析,以此来确定是否为 CDV 野毒株感染。 Yi 等建立用于区分CDV 野毒株与疫苗株的等位基因特异性 RT -PCR 方法,而采用病毒分离培养方法却无法区分,该方法可用于 CDV 的临床检测和流行病学监测,具有很强的特异性。
3.3 TaqMan 实 时 荧 光 定 量 RT - PCR 和 SYBRGreenⅠ 实时荧光定量 RT - PCR
常规 RT - PCR 仅对反应的终产物进行定性定量分析,而实时荧光定量 RT - PCR可对反应中每循环进行定性定量分析,与常规 RT - PCR 相比,实时荧光定量 RT - PCR 具有自动化程度高、操作简单、解决PCR污染问题、特异性更强、灵敏度高、可直接对产物进行定量的特点。常用的实时荧光定 量 PCR 试 剂 有 TaqMan 水 解 探 针、 SYBRGreenⅠ 和分子信标。其中 SYBR GreenⅠ 可用于多种模板、灵敏度高、使用方便、价格相对便宜,较常用; TaqMan探针特异性高,是只有引物和探针都与同一模板结合时才能检测,可在一次反应中同时检测多个不同的序列,但该探针只适于一个特定的目标;分子信标可用于单核苷酸多态性的检测,尤其适用于检测点突变,但该探针设计困难、价格昂贵,一般不用。全传松等根据CDV核衣壳蛋白(NP )基因的保守序列设计引物和探针,并经反应体系和反应条件的优化,建立了 TaqMan实时荧光定量 RT -PCR检测方法。试验结果显示,该法敏感性是常规 RT - PCR方法的100倍;特异性强,与其他犬类病毒不发生交叉反应;稳定性好,组内、组间变异系数均小于5% 。该 法 适 于 犬 瘟 热 的 早 期 诊 断。李 菊 梅 采 用RT - PCR扩增 CDV F 基因并构建、纯化 pMD18 - T - F重组克隆质粒,并以此为模板作荧光定量PCR扩增,建立了CDV SYBR GreenⅠ 实时荧光定量RT -PCR检测方 法,用 此 法 检 测 病 料 检 出 率 明 显 高 于 常 规RT - PCR方法,该方法的建立可为犬瘟热诊断、分子流行病学调查、疫情监测工作的开展提供技术依据。
3.4 双重PCR方法
多重PCR技术是以PCR技术为基础发展起来的一种检测方法,在一次反应中同时检测多种病原,与单一PCR相比,不仅保持了较高的敏感性和特异性,而且能检测混合感染,具有较高的临床应用价值。对于犬科动物病毒性疾病的检测,双重PCR方法研究报道较多,即在一次反应中同时检测两种病原。由于双重 PCR 反应需两对引物和两种模板,极易出现非特异性扩增或无法扩增,因此在引物设计时应注重选择合适的基因片段长度、退火温度和 GC含量。依据双重 PCR 检测技术,刘大飞等 、耿庆华等 、孙园园等均建立了 CDV 另外一种病毒的双重PCR 检测方法,其敏感性明显高于商品化胶体金试纸条,并有利于检测出两种毒混合感染病料,且与普通 PCR检测结果的符合率在98%以上,该法可在临床中推广应用。
4 新型高效检测技术
4.1 基因芯片技术
基因芯片技术是高效和高通量的检测技术。国内外有关基因芯片技术应用于人类疾病早期诊断研究的报道较多,而在动物性疾病的研究方面相对较少,目前国内还未有用于检测动物性疾病的标准基因芯片投放市场,整体还处于研制和开发阶段。朱晓光等设计出 CDV 寡核苷酸探针,建立样品PCR扩增方法,制备基因芯片,建立了 CDV 目视化基因芯片检测方法,并以 TCID 50 为10-2CDV 细胞毒为样品,检测出该基因芯片的灵敏度比普通 PCR的灵敏 度 高 100 倍,病 料 检 测 与 PCR 符 合 率 为100% 。表明该方法具有灵敏度高、特异性强的特点,适用于CDV 的流行病学调查和种特异性鉴定。
4.2 液相芯片技术
液相芯片技术是一种继蛋白质芯片和基因芯片之后创新地将流式细胞术与荧光微球结合的新型多通道高通量生物芯片检测体系,可同时对同一血清样品中多种病原抗体进行定性分析,实现多种病原抗体的实时检测。液相芯片检测体系一般分为两种:抗原—抗体反应液相蛋白芯片和核酸杂交反应液相基因芯片。张海雷采用液相蛋白芯片技术制备CDV 重组 H 蛋白捕获微球,建立的 CDV抗体液相芯片检测方法,具有特异性强、敏感性高、重复性和稳定性好等特点,与ELISA试剂盒的检测结果符合率高,可作为ELISA 试验的替代技术用于检测CDV 抗体水平。
4.3 环介导等温扩增技术
环介 导 等 温 扩 增 (loop - mediated isothermal
amplification , LAMP )技术自2000年首次由日本学者开发以来,已在多种细菌性、病毒性和寄生虫性疾病的检测方面得到了广泛的应用。该技术是一种全
新的核酸扩增方法,能在等温条件下短时间内进行核酸扩增,具有简单、快速、强特异性等特点。与普通PCR相比,不需要模板的热变性、温度循环、电泳及紫外观察等过程,在灵敏度、特异性和检测范围等方面堪比甚至优于PCR 技术,且不依赖任何专门仪器设备即可实现现场高通量快速检测,其检测成本远低于荧光定量 PCR 。胡嘉欣等采用反转录环介导等温扩增( RT - LAMP)技术对 CDV N 基因保守区的8个位点设计6条引物进行 RT - LAMP 一步法扩增,试验结果表明该法的灵敏度是 RT - PCR的 103倍,整个试验过程比 RT - PCR 缩短1.5h ,具有成本低、方便快捷等优点,适于兽医临床诊断和流行病学调查等相关研究。温海等也建立了检测CDV的 RT - LAMP方法,并与 RT - PCR方法相比,试验结果显示该法的检出率更高,不易出现假阴性结果
【防治】
为有效防控犬瘟病毒对易感动物的危害,必须做到预防与治疗并重
1.预 防
1.1 若发生疫情,为防止疫情蔓延,应迅速将病犬隔离,选用火碱,漂白粉或来苏儿等消毒剂对犬舍,运动场及周围环境进行彻底消毒,停止犬调动,禁止无关人员来往,对尚未发病的假定健康犬及受威胁的其它动物,可用犬瘟热高免血清或单克隆抗体做紧急预防注射,待疫情稳定后,再注射犬瘟热疫苗。
1.2 家庭中若病犬死亡后,要做到严格消毒,不留隐患。要妥善处理病死犬的尸体及用品用具等,最好焚烧、或消毒后深埋;对想保留的用具可采取水煮,阳光暴晒,或消毒剂浸泡等方式。对其污染的室内环境进行彻底消毒,可用来苏儿,84,次录酸钠等消毒剂每日消毒2次,连续消毒10天,这样可以减少再次购入犬的感染机会。 如想再次购入新犬,在严格消毒10天以后就比较安全了。
1.3 防疫、美容和就诊最好去正规的、消毒条件好的动物医院,以防医源性感染。 对基础免疫没有完成的犬,因其体内还没有产生足够的抗犬瘟热病的抗体, 最好不要带到公共场所去遛玩,以防感染发病。 若居住地附近有犬瘟热病犬,最好不要带犬外出散步,并加强犬舍消毒。 若犬主人有接触过病犬史,还要对其主人的全身(包括手、衣服、鞋子等)进
行彻底的消毒处理后方可接触自己的爱犬; 如怀疑爱犬与病犬有过接触,最好立即注射 1 针抗体,并在7~15天内密切关注其有无异常,以防患于未然。
1.4 选购爱犬时,最好从正规的养犬场或家庭购买,并详细询问免疫情况。如果是从狗市上购买的犬,因不清楚其是否免疫过,以及在市场上是否接触过病犬,最好先注射一针单克隆抗体或血清,并隔离饲养15 d 左右,确认健康后方可进行疫苗补种。
2.免 疫
平时严格执行动物卫生防疫措施,定期接种疫苗,可有效预防犬瘟热。目前我国生产的犬瘟热疫苗是细胞培养弱毒疫苗。 为了提高免疫效果,应按以下免疫程序进行。 仔
犬 6 周龄为首次免疫时间, 8 周龄进行第 2 次免疫,10 周龄进行第 3 次免疫。 以后每年免疫 1 次,
3.治 疗
对犬瘟热患犬的治疗必须做到早确诊、早治疗,才可提高治愈率。对病犬应加强饲养管理,加强营养,进行隔离治疗。由于犬瘟热属于病毒性传染病, 没有特效药, 治疗时应遵循中和病毒,增强免疫,增强机体抵抗力,抗病毒,抗菌消炎、强心补液,纠正酸碱及电解质紊乱为重点的治疗原则。 另外还要注意对症治疗及支持疗法。
犬瘟热初期给予注射大剂量的高免血清和单克隆抗体治疗效果比较好,如果患犬已经出现神经症状再给予,则不见明显治疗效果。
【犬瘟热治疗常用药物】
血 清:高免血清,单克隆抗体
生物制剂:一般有免疫球蛋白和转移因子,干扰素、胸腺肽。
抗病毒药物:病毒灵(盐酸吗啉双呱)和病毒唑(利巴韦林),金刚烷胺和聚肌胞,炎琥宁、穿琥宁。
止吐灵和654 -2(盐酸山莨碱),胃复安或爱茂尔
止咳药种类繁多,氨茶碱、咳必清、甘草片及各种止咳糖浆、膏;化痰可用氨溴索。
氯硝西泮镇静,谷维素调节神经,B1,B12等营养神经。
抗生素的家族庞大,可选用头孢类,大环内酯类
糖皮质激素能够有效缓解炎症,但应控制剂量,大剂量会造成免疫抑制;葡萄糖酸钙能够
降低毛细血管通透性,制止渗出;呋噻咪等利尿剂能够促进肺部渗出液的吸收和排泄, 二者均能够减轻肺部炎症;促凝血药物能够缓解消化道出血。
适当补充营养、电解质和水分,可以帮助危重病犬恢复体力,提高机体免疫力,进而耐过急重期而存活下来。 通常经静脉补给葡萄糖、复方氯化钠溶液,并加入 CoA 、维生素 C 、复合维生素 B 、 ATP 、氨基酸等营养物质。但如果病犬并发有肺部炎症,则不适宜大量
输液,以免加重肺脏的负担。
中药有双黄连,清开灵,板蓝根,柴胡注射液,安宫牛黄丸,牛黄清心丸等。
参考文献
程世鹏,易 立. 犬瘟热病原学研究进展(中国农业科学院特产研究所,吉林 )
苏凤艳,李 哲,刘千辉,王全凯. 犬瘟热诊断技术的研究进展(吉林农业大学中药材学院,长春 130118 )
[1] Green R G.Distemper in the silver fox.Proc Soc Exp BoilMed[J].1925,22:546- 548.
[2] 关中湘,王树志,陈启仁.毛皮动物疾病学[M].北京:农业出版社,1982,311- 312.
[3] 韩磊,靳兴军,郭峰,等.虎犬瘟热病毒的分离与初步鉴定[J].中国兽医杂志,2004,40(2):30.
[4] 李金中,夏咸柱,胡桂学,等.我国犬瘟热病毒的生态学调查研究[J].畜牧兽医学报,1999,30(4):375- 379.
[5] Gassen U,Collins F M,Duprex W P,et al.Establishment ofa rescue system for canine distemper virus[J].J Virol,2000,74(22):10737- 10744.
[6] Yoshida E,Iwatsuki K,Miyashita N,et al.Molecular anal-ysis of the nucleocapsid protein of recent isolates of caninedistemper virus in Japan[J].Vet Microbiol,1998,59(2- 3):237- 244.
[7] Hamburger D,Griot C,Zurbriggen A,et al.Loss of virulenceof canine distemper virus is associated with a structuralchange recognized by a monoclonal antibody[J].Experientia,1991,47(8):842- 845.
[8] Curran M D,Clarke D K,Rima B K.The nucleotide sequenceof the gene encoding the attachment protein H of caninedistemper virus[J].J Gen Virol,1991,72(2):443- 447.
[9] Stettler M,Zurbriggen A.Nucleotide and deduced amino acidsequences of the nucleocapsid protein of the virulent A75/17- CDV strain of canine distemper virus [J].Vet Microbiol,1995,44(2):211- 217.
[10] Steward M W.Epitopes identified with a defective recom-binant adenovirus expressing measles virus nucleoproteinand evaluation of their protective capacity in mice[J].VirusRes,1999,65(1):75- 86.
[11] Cherpillod P,Beck K,Zurbriggen A,et al.Sequence analysisand expression of the attachment and fusion proteins of ca-nine distemper virus wild- type strain A75/17 [J].J Virol,1999,73(3):2263- 2269.
[12] Iwatsuki K,Miyashita N,Yoshida E,et al.The nucleotideand predicted amino acid sequence of the fusion protein ofrecent isolates of canine distemper virus in Japan[J].J VetMed Sci,1998,60(3):381- 385.
[13] Bolt G.,Jensen T,Gottschalck E,et al.Genetic diversity ofthe attachment (H)protein gene of current field isolates ofcanine distemper virus[J].J Gen Virol,1997,78(2):367-372.
[14] Hirayama N,Senda M,Nakashima N,et al.Protective effectsof monoclonal antibodies against lethal canine distempervirus infection in mice[J].J Gen Virol,1991,72(11):2827- 2830.
[15] 何洪彬,李金中,夏咸柱,等.熊猫等动物犬瘟热病毒附着蛋白基因的遗传多样性[J].病毒学报,2000,17(3):238-241.
[16] West J L,McNutt S H,Brandly C A.Adaptation of fox dis-temper virus to embryonating chicken eggs[J].Cornell Vet,1956,46:39- 50.
[17] 何洪彬,夏咸柱.犬瘟热的诊断及其预防免疫的研究进展[J].动物医学进展,2001,22(1):12- 15.
[18] 钱国成,郭淳久,王斌.水貂犬瘟热弱毒鸡胚细胞疫苗[J].中国兽医杂志,1981,7(8):7- 10.
[19] 高云,曲维江,籍玉林,等.我国貂瘟、狗瘟病原分离、鉴定的研究[J].畜牧兽医学报,1983,14(1):35- 41.
[20] 华国荫,刘鼎新,吴英平,等.犬瘟热强毒的分离和培育[J].家畜传染病,1983, (3):8- 13.
[21] 何洪彬,李金中,夏咸柱,等.大熊猫犬瘟热病毒附着或血凝蛋白基因的序列分析[J].中国病毒学,2000,15(3):291- 295.
[22] 王君玮,姜平,王志亮,等.貂、狐、貉源犬瘟热病毒分离株H 和 N 基因的遗传多样性分析[J].南京农业大学学报,2007,30(4):108- 113.
[23] 朱军莉,余旭平,张登详,等.犬瘟热病毒 Guizhou 株血凝素基因的克隆及序列分析[J].中国兽医学报,2006,26(1):17- 19.
[24] 王风雪,闫喜军,柴秀丽,等.犬瘟热疫苗株 CDV3 核蛋白基因全序列测序及分析[J].特产研究,2007,296(4):7- 10.
欲了解更多犬瘟热细小病毒相关内容,请点击此处《《犬瘟热细小病毒百科》》
----------------- 原创文章 知识产权所有 禁止转载抄袭 -------------------